Une approche combinée pour cibler la tumeur et son microenvironnement
Contexte
Les glioblastomes sont les tumeurs cérébrales les plus agressives et représentent un défi majeur en oncologie. Issus des cellules gliales, ils se caractérisent par une prolifération rapide, une infiltration diffuse du tissu cérébral sain et une résistance aux traitements conventionnels. Leur impact sur les patients est dramatique, entraînant un déclin neurologique progressif, des troubles cognitifs et une réduction significative de l’espérance de vie, avec un pronostic médian ne dépassant souvent pas 15 mois après le diagnostic, malgré les thérapies actuelles.
Le traitement standard repose sur une approche multimodale combinant la chirurgie, la radiothérapie et la chimiothérapie avec le témozolomide. mais reste limités l’infiltration tumorale, la barrière hémato-encéphalique et la résistance aux thérapies. La thérapie par champs électriques (TTF) a montré un léger gain de survie, mais son coût élevé complique leur généralisation, en particulier pour les systèmes de santé et les pays à faibles ressources. D’autres approches thérapeutiques sont en cours d’exploration, notamment l’immunothérapie, la thérapie génique et les nanoparticules ciblées, mais leur efficacité reste à démontrer dans des essais cliniques.
Trouver un traitement permettant d’augmenter la survie et la qualité de vie des patients atteints de glioblastome demeure une priorité absolue
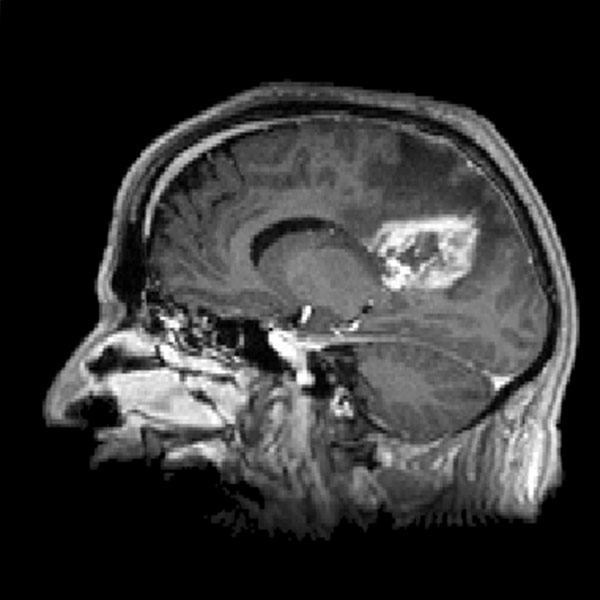
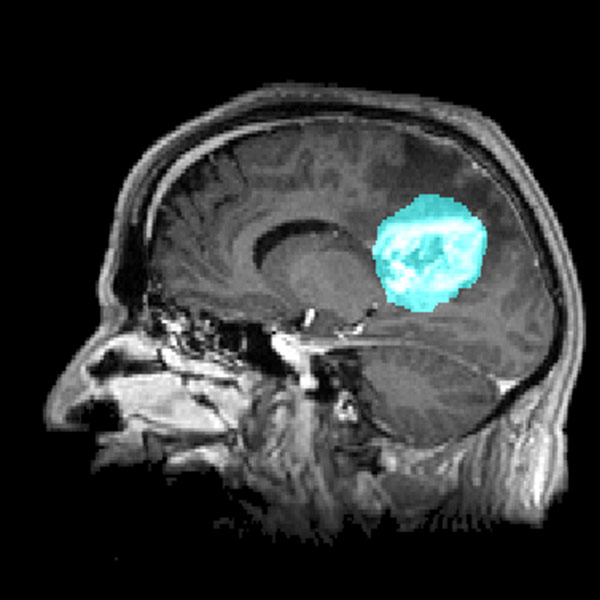
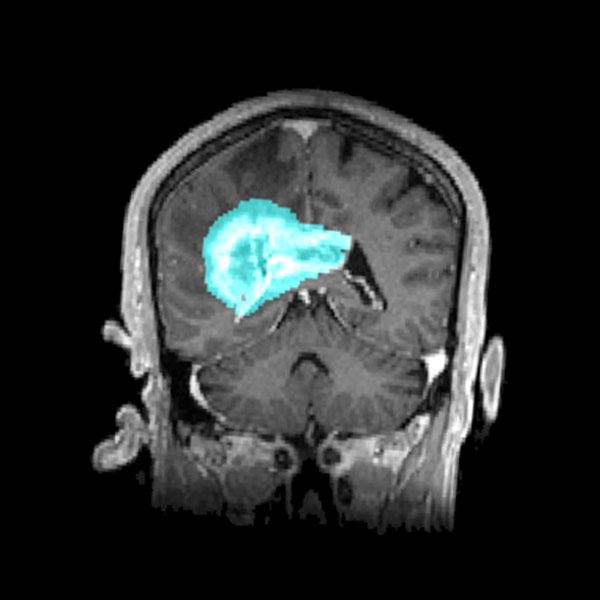
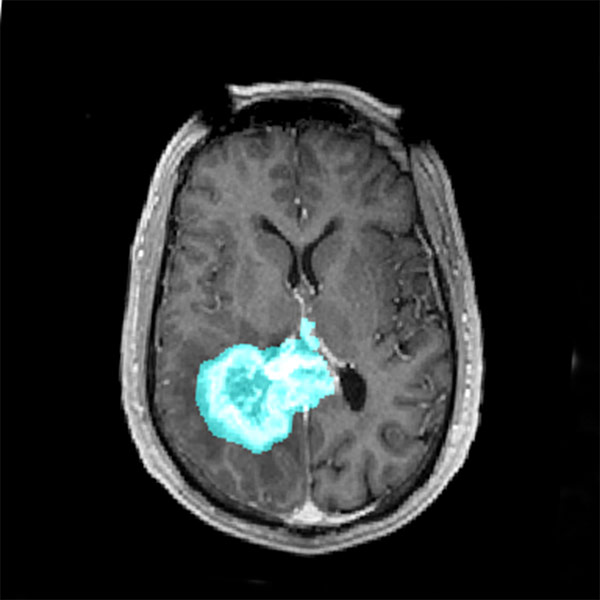
Le microenvironnement tumoral joue un rôle crucial dans la progression des glioblastomes, mais il reste sous-estimé dans le développement des thérapies. Des études récentes ont mis en évidence l’interaction étroite entre les cellules tumorales et l’environnement neuronal, révélant que les glioblastomes établissent des connexions synaptiques fonctionnelles avec les neurones environnants. Cette communication aberrante induit une hyperactivité neuronale qui stimule la prolifération et la dissémination tumorale.
Plus connu, le glutamate joue un rôle dans l’hyperexcitabilité du microenvironnement tumoral des glioblastomes. En libérant excessivement ce neurotransmetteur, les cellules tumorales activent les récepteurs NMDA et AMPA, favorisant ainsi leur prolifération, migration et l’angiogenèse. Cette excitotoxicité modifie aussi l’activité des cellules gliales, notamment les astrocytes, qui libèrent des molécules inflammatoires renforçant un environnement pro-tumoral.
Des études plus récentes (Barron, Tara, et al. 2025) ont mis en avant une modification de la signalisation GABAergique dans cet environnement tumoral. Normalement inhibiteur dans les neurones matures, le GABA (acide gamma-aminobutyrique) devient excitateur dans les cellules tumorales en raison d’une accumulation anormale de chlorure intracellulaire, due à la surexpression de NKCC1, un importateur d’ions chlorure. Cette altération favorise la croissance tumorale et crée un cercle vicieux où l’activité neuronale alimente l’expansion du glioblastome au lieu de la freiner.
Ces découvertes soulignent l’importance d’intégrer le microenvironnement tumoral dans les stratégies thérapeutiques. Cibler la communication entre les cellules cancéreuses et les neurones, notamment en modulant la signalisation GABAergique, pourrait offrir de nouvelles perspectives pour freiner la progression du glioblastome et améliorer l’efficacité des traitements actuels.
Projet
Face à ce constat, B&A Oncomedical, en collaboration avec Neurochlore, a lancé un projet innovant reposant sur une approche combinée de deux molécules afin de proposer un traitement plus efficace et mieux toléré, en agissant non seulement sur la tumeur elle-même, mais aussi sur son environnement, clé de sa progression.
La Bumétanide (BUM)
La Bumétanide (BUM), un traitement diurétique, suscite un intérêt croissant en oncologie.
Son action repose sur l’inhibition du co-transporteur NKCC1, une protéine impliquée dans la régulation des flux ioniques et fortement surexprimée dans les cellules tumorales de glioblastome. En bloquant NKCC1, la Bumétanide réduit l’accumulation de chlorure intracellulaire, rétablissant l’effet inhibiteur du GABA et atténuant ainsi l’hyperexcitabilité neuronale, un facteur clé de la progression tumorale.
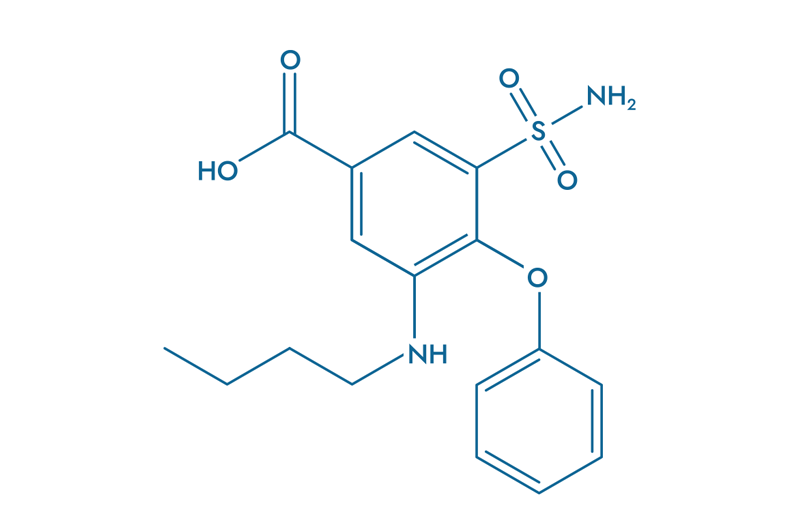
- Bloque l’hyperactivité neuronale
- Réduit l’excitabilité neuronale liée à la tumeur
- Diminue l’interaction entre neurones et cellules cancéreuses
- Prévient la migration tumorale
- Prévient les métastases
La Bumétanide (BUM)
Le Mébendazole (MBZ), est un agent antiparasitaire bien connu pour sa capacité à cibler les microtubules.
En inhibant la polymérisation des microtubules, le MBZ empêche la division cellulaire et favorise l’apoptose des cellules cancéreuses. Ce médicament a déjà démontré son efficacité anticancéreuse à travers de nombreuses études expérimentales, ainsi que lors d’une phase I/II menée sur des patients atteints de glioblastome par une équipe de l’Université Johns Hopkins (Gallia, Gary L., et al., 2021).
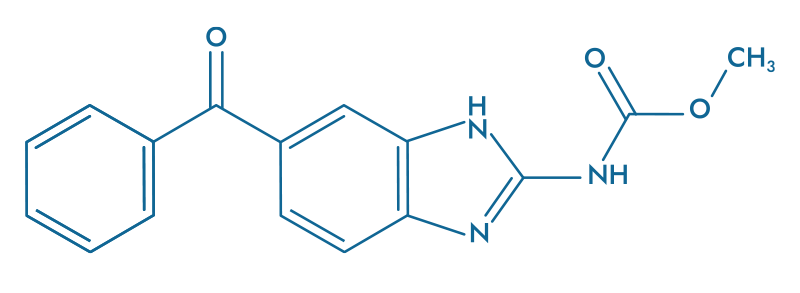
- Bloque l’hyperactivité neuronale
- Réduit l’excitabilité neuronale liée à la tumeur
- Diminue l’interaction entre neurones et cellules cancéreuses
- Prévient la migration tumorale•Prévient les métastases
Fort de son expertise variée dans des domaines d’application ex vivo et in vitro, B&A Oncomedical, en collaboration étroite avec le Pr F. Berger et ses équipes à Grenoble, a mis en œuvre des méthodologies de pointe pour évaluer le potentiel thérapeutique de cette combinaison. Ces approches incluent l’utilisation de modèles de tumoroïdes en culture 3D et on-chip, ainsi que des enregistrements électrophysiologiques sur tranches corticales murines et l’étude de tumeurs fraîchement réséquées – avec, pour la première fois, des mesures directes des canaux GABA individuels et des taux de chlorure intracellulaire (Cl⁻). En raison de leur capacité à reproduire plus fidèlement l’architecture et les interactions cellulaires observées in vivo, ces modèles permettent d’explorer non seulement les effets directs des traitements sur les cellules tumorales, mais aussi d’étudier les interactions complexes au sein du microenvironnement tumoral, essentiel pour la progression et la résistance des tumeurs.
Résultats et perspectives
À partir des différentes expériences réalisées par nos équipes, nous avons pu observer le potentiel de la combinaison du Mébendazole et de la Bumétanide dans le traitement du glioblastome.
En exploitant des mécanismes d’action cellulaires complémentaires, le COMBO permet une réduction de la superficie tumorale et une augmentation de la mort cellulaire dans les cellules tumorales.
De plus, face à l’hyperexcitabilité synaptique, favorisée par le glioblastome et responsable de l’apparition de crises épileptiformes, cette combinaison a montré des effets anticonvulsivants, en bloquant l’hyperexcitabilité des cellules cancéreuses, et ce, à faible concentration.
Enfin, dans le cadre d’un essai pilote compassionnel, l’administration du COMBO chez un patient a montré une augmentation remarquable de l’espérance de vie.
En conclusion, l’association du Mébendazole et de la Bumétanide présente un intérêt thérapeutique majeur pour le traitement du glioblastome, non seulement en réduisant la migration tumorale et en augmentant l’apoptose des cellules cancéreuses, mais également en agissant de manière synergique à faibles doses sur l’hyperexcitabilité de l’environnement tumoral, ouvrant ainsi la voie à de nouvelles stratégies thérapeutiques pour cette tumeur cérébrale agressive.
Ces résultats prometteurs, couverts par une demande PCT, ouvrent la voie à une approche thérapeutique innovante, ciblant à la fois les cellules tumorales et leur environnement neuronal, avec des perspectives d’application potentielles à d’autres tumeurs cérébrales. Notre objectif est désormais de sécuriser des financements et de mobiliser des investisseurs afin de lancer un essai clinique de phase 2/3 évaluant l’efficacité de la combinaison BUM x MBZ pour le traitement des glioblastomes et d’autres tumeurs du cerveau.






